 |
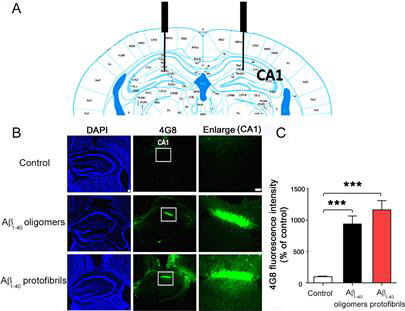
| Amyloid-β (1-40) 올리고머와 프로토피브릴의 아밀로이드 플라크 형성 |
한국기초과학지원연구원(KBSI)은 분석과학연구본부 바이오융합연구부 이영호(UST 생물분석과학전공 교수) 박사팀을 비롯한 한·미·일 공동연구팀이 치매를 유발하는 아밀로이드 베타(Alzheimer's amyloid-β (1-40), 이하 에이베타) 펩타이드의 다양한 응집체 형성과정을 규명하는데 성공했다고 1일 밝혔다.
에이베타 펩타이드는 특별한 구조 없이 실처럼 풀린 모양으로 뇌척수액 속에 녹아 있는데 이것이 응집되면 베타 구조를 갖는 섬유 형태의 아밀로이드 피브릴(amyloid fibril)이 돼 아밀로이드 플라크를 만들게 된다.
아밀로이드 플라크는 노인성 치매 환자의 뇌에서 발견되는 반점처럼 생긴 덩어리를 말한다.
연구팀은 이 과정에서 기름성분, 알코올, 산성도, 이온강도와 같은 환경요소가 에이베타 펩타이드의 구조와 용해도에 영향을 미쳐 다양한 아밀로이드 피브릴 형성 과정이 발생한다는 것을 규명하는데 성공했다.
에이베타 펩타이드가 녹아있는 수용액에 기름성분이나 알코올 성분이 많아지면 수용액의 극성이 바뀌며 풀린 실 같던 에이베타 펩타이드의 중간 중간에 용수철과 같은 나선 구조가 생긴다. 에이베타 펩타이드가 나선 구조를 일부분 갖게 되면 물에 잘 녹지 않게 돼 실 모양일 때보다 아밀로이드 피브릴로 더 쉽게 응집이 일어난다.
하지만 나선 구조가 많은 경우에는 오히려 물에 잘 녹아 응집이 잘 일어나지 않게 된다. 수용액의 기름성분이나 알코올 성분이 줄어들면 나선구조의 비중이 줄어들면서 올리고머(oligomer)나 프로토피브릴(protofibril)이라는 또 다른 형태의 단백질 응집체를 이루게 되는데, 산도와 이온의 양의 변화에 따라 다시 아밀로이드 피브릴이 되기도 한다.
에이베타 펩타이드가 아밀로이드 피브릴이나 올리고머와 같은 응집체를 이루는 사례는 이미 보고가 된 바 있지만 그 원리를 규명하고 다양한 응집체 형성 경로를 분자 수준에서 밝힌 것은 이번 연구가 처음이다.
KBSI 이영호 박사는 "이번 연구로 단백질 응집체의 형성과정, 응집 전구체 단백질과 응집체의 구조와 형태가 밝혀져 치매, 파킨슨병, 이형당뇨병, 뤼게릭병, 백내장, 프리온병 등 아밀로이드 피브릴 형성이 유발하는 질병의 신약개발에 획기적인 도움이 될 것"이라며 "앞으로 고령화 사회의 주요 질병에 관한 기초, 응용 및 분석 연구를 주도해 나갈 것"이라고 밝혔다.
김성현 기자 larczard@
중도일보(www.joongdo.co.kr), 무단전재 및 수집, 재배포 금지
 김성현 기자
김성현 기자

![[尹정부 반환점 리포트] ⑪ 충북 현안 핵심사업 미온적](https://dn.joongdo.co.kr/mnt/webdata/content/2024y/11m/21d/118_2024112101001603200062341.jpg)



![[기획]`대한민국의 스페이스X를 꿈꾼다`... 페리지에어로스페이스의 도전](https://dn.joongdo.co.kr/mnt/webdata/content/2024y/11m/20d/78_2024112001001447200056411.jpg)











