 |
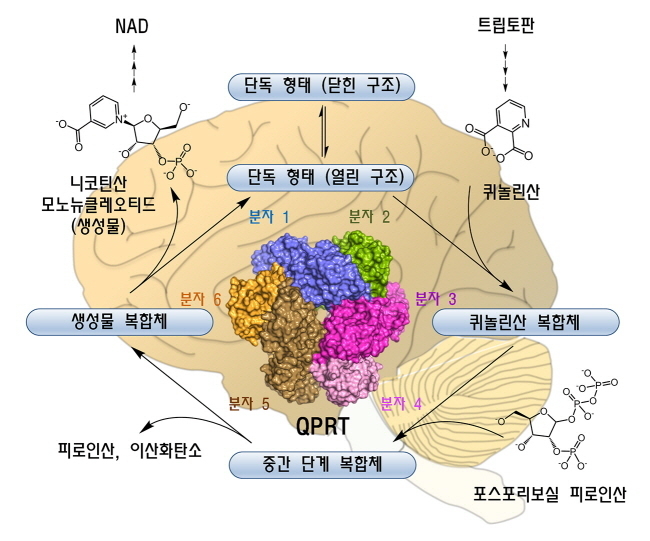
| ▲인간 QPRT 6량체에 의한 조효소 NAD 생합성 경로
QPRT는 필수아미노산인 트립토판으로부터 형성된 퀴놀린산에 포스포리보스를 결합해 NAD의 생합성 전구체인 니코틴산 모노뉴클레오티드를 생성하는 반응을 매개한다. 제공=한국연구재단 |
국내연구진이 악성뇌종양을 유발하는 것으로 알려진 퀴놀린산 전이효소(화합물의 특정 작용기를 다른 물질로 옮기는 효소) 작동원리를 처음으로 규명했다.
16일 한국연구재단(이사장 정민근)에 따르면 미래창조부의 지원으로 광주과학기술원 엄수현 교수 연구팀이 에너지 생산효율을 극대화하는 체내 조효소인 NAD(니코틴아미드 아데닌 디뉴클레오티드·세포호흡과정에서 산화적 인산화를 매개해 에너지 생산효율을 극대화하는 조효소)를 합성하는 퀴놀린산 포스포리보스 전이효소(QPRT)의 고해상도 3차원 구조와 기능을 밝혀냈다.
엄 교수팀의 이번 QPRT 작용원리 규명은 신경퇴행성 질환과 뇌종양 치료제 개발에도 크게 이바지할 것으로 기대된다.
다름 아닌 퀴놀린산은 신경 독소로 작용하는데 신경계에 과다하게 축적되면 다양한 신경퇴행성 질환과 신경교세포가 변이된 종양인 신경교종, 즉 악성 뇌종양을 유발한다.
때문에 전이 반응을 통해 신경계 내 퀴놀린산을 다른 물질로 바꾸는 QPRT의 기능을 연구해 퀴놀린산의 신경계 내 축적을 방지하는 원리를 밝히고, 이를 이용해 신약을 개발하는 연구가 진행중이다. 그러나 아직 QPRT의 효소반응 단계별 3차원 구조가 밝혀지지 않아 QPRT의 작용 원리를 파악하지 못하고 있다.
이에 엄수현 교수팀은 X-선 결정학 기법을 이용해 인간 QPRT의 효소반응 단계별 고해상도 3차원 구조를 규명하고, QPRT가 6량체로 존재함으로써 효소의 반응이 진행되는 동안 활성부위가 열린 형태로부터 닫힌 형태로 광범위한 구조적 변화가 일어난다는 사실을 확인했다.
현재까지는 모든 종의 QPRT에서 닫힌 구조만이 보고됐지만 엄 교수 연구팀이 이번에 인간 QPRT의 열린 구조를 최초로 규명한 것이다.
아울러 효소반응 단계별 구조를 규명함으로써 QPRT의 효소 작용 원리를 알아냈다.
연구팀은 또한 원핵생물의 QPRT는 2량체로 활성을 가지지만 인간을 포함한 진핵생물의 QPRT는 6량체로 존재하는 이유와 관련 생화학/생물리화학 연구를 통해 2량체보다 6량체를 형성함으로써 안정성, 효소활성 등이 비약적으로 향상되는 방향으로 진화됐다는 사실을 찾아냈다.
연구팀은 이를 바탕으로 신경교종 치료제 개발에도 크게 이바지할 것으로 내다봤다.
엄수현 교수는 “이번 연구 성과는 QPRT에 의해 신경독소 퀴놀린산이 뇌 안에서 일정 량을 유지하는 원리를 처음으로 밝힌 것으로 알츠하이머병, 간질 등 다양한 신경퇴행성 질환, 뇌종양 치료제 개발에 기여할 것으로 기대돼 학계의 관심이 쏠리고 있다”고 말했다.
연구성과는 세계적 학술지 네이처(Nature) 자매지인 사이언티픽 리포트(Scientific Reports) 1월 25일자에 게재됐다. /이승규 기자 esk@
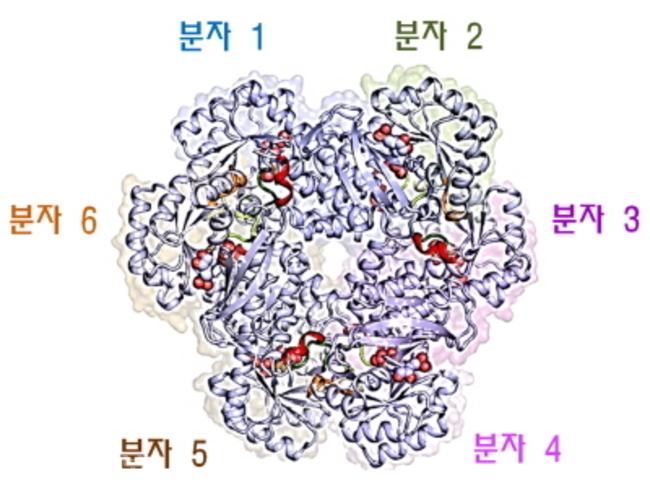 |
| ▲인간 QPRT 6량체의 3차원 구조
QPRT는 두 분자 사이에 활성부위를 갖는 2량체가 기본 단위이며 하나의 알파-나선과 두 고리에 의해 6량체를 형성한다. 제공=연구재단 |
중도일보(www.joongdo.co.kr), 무단전재 및 수집, 재배포 금지
 이승규 기자
이승규 기자

![[尹정부 반환점 리포트] ⑪ 충북 현안 핵심사업 미온적](https://dn.joongdo.co.kr/mnt/webdata/content/2024y/11m/21d/118_2024112101001603200062341.jpg)



![[기획]`대한민국의 스페이스X를 꿈꾼다`... 페리지에어로스페이스의 도전](https://dn.joongdo.co.kr/mnt/webdata/content/2024y/11m/20d/78_2024112001001447200056411.jpg)











